财经 来源:东方财富 阅读量:18845 2021-09-26 18:12
从一年多到平均只有50天,2015年开始的中国药品审评改革,为加快新药上市发挥了巨大作用。
这项改革如何帮助中国的药物研发,产生中国的创新活力我国新药研发发生了哪些变化面对目标集群,重复申请等问题,制药企业应如何转变R&D思维国家医药产品管理局药品审评中心制定的药品审评标准作为新药审评标准的指挥棒,是业界关注的焦点
CDE 7月初发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》,多家创新药企股价随即下跌,反映出市场对新药监管的敏感性。
在药物创新的过程中,制药公司还没有摆脱仿制药的想法日前,在第六届中国医药创新与投资大会上,CDE副主任周思源透露,《原则》只是CDE今年要推出的108条指导意见之一,未来还会有更多适应医药创新发展规律的要求
新药审批加快,技术要求符合国际标准。
根据周思源提供的数据,2019年至2021年8月底,CDE共受理登记申请25535件,审结登记申请25120件三年来,进出任务数基本平衡从2021年初至今,正常时限内的复核率已达到98%
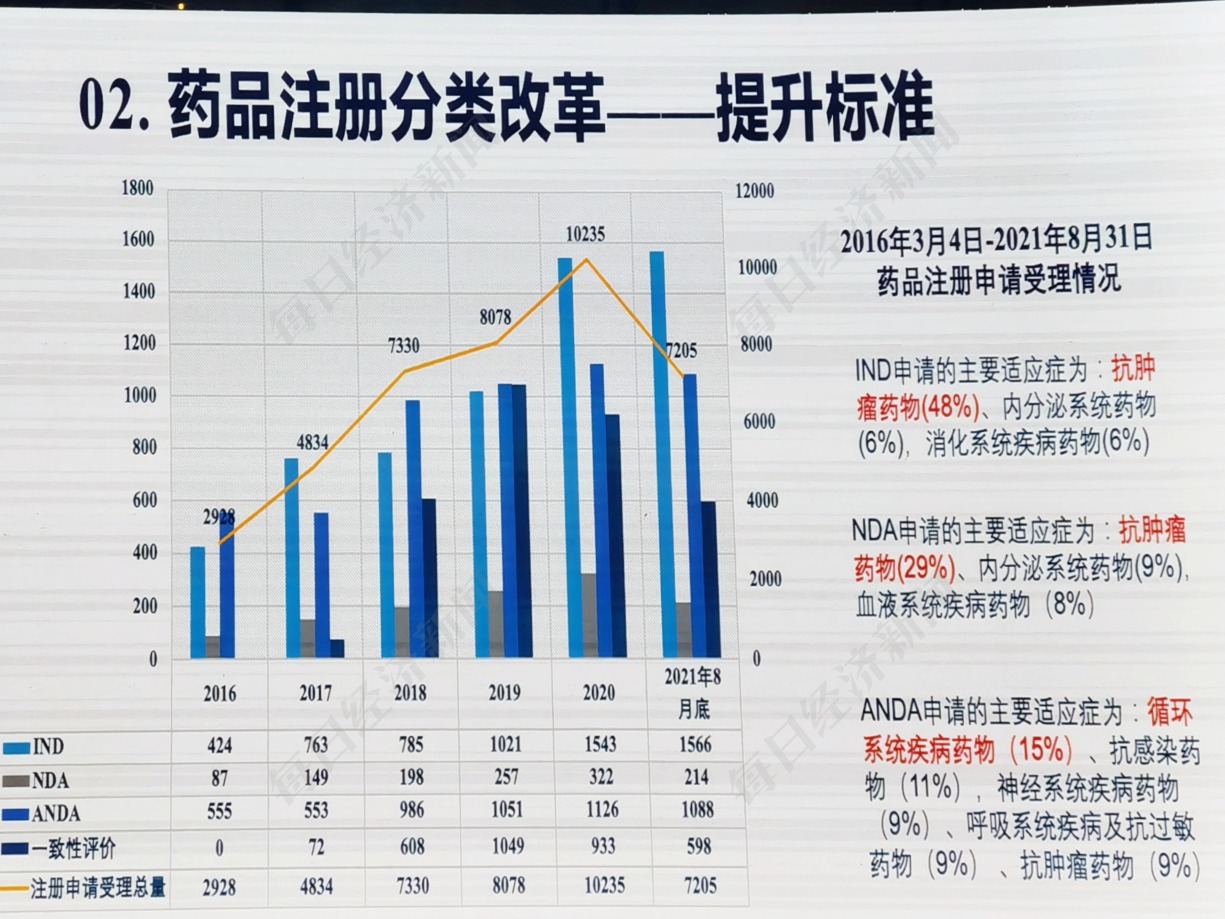
从药品注册申请受理的适应症来看,药品注册分类改革提高了标准,抗肿瘤药物成为药企的宠儿。
2016年3月4日至2021年8月31日,IND应用的主要适应症为抗肿瘤药物,内分泌系统药物和消化系统疾病药物NDA的主要适应症是抗肿瘤药物,内分泌系统药物和血液系统疾病药物ANDA申请的主要适应症为循环系统疾病药物,抗感染药物,神经系统疾病药物,呼吸系统疾病药物和抗过敏药物,抗肿瘤药物
从建立临床试验申请默示许可制度的影响来看,CDE近三年共受理临床试验申请4182件,审查临床试验申请3992件,其中批准一类创新药物临床试验申请2491件临床试验申请的平均审查时间从2015年的16个月缩短至50天
而建立渠道对加快药品上市的影响也不容忽视自2016年2月实施优先审查制度至今年8月底,已有784份注册申请通过优先审查批准上市,从2020年7月实施《药品注册管理办法》到今年8月底,已有67个突破性药物申请纳入突破性药物计划55个注册申请获得批准上市并附条件,四种新冠肺炎疫苗通过特别批准程序获准上市
此外,周思源表示,大力推进技术要求国际接轨,是审评审批改革助力中国医药创新走向国际的重要事件一方面,CDE积极转变和实施非物质文化遗产指导原则ICH指导原则有63条,其中46条目前已全面实施,其余17条预计2022年全面转化实施,另一方面,要加强药物研究适时指导原则的建设截至2021年8月,药检中心共起草发布了318条指导原则2020年,药检中心起草发布了119项指导原则,2021年计划修订108项指导原则
在此背景下,中国制药企业走向全球的道路更加顺畅2015年至2021年8月,国家医药产品管理局共批准创新药物72种,中美双方共报告创新药物4种
从治疗领域来看,2018—2020年,抗肿瘤药物占FDA批准治疗领域的31%,是最大的一部分,但其治疗领域是多元化的,涉及几种罕见病,可是,中国批准的新药治疗范围相对简单。
我国药物创新缺乏多样化,罕见病的缺点和对儿童药物研发重视不够,也体现在快手品种的适应症分布上据周思源介绍,近三年,抗肿瘤药物占I类创新药物临床试验申请批准适应症的54%,分别占突破性药物治疗程序和有条件批准程序的59%和70%
除了新药研发过于集中在抗肿瘤领域外,周思源还指出,目前国内研发基础相对薄弱,跟风,买账,重整的趋势导致产品同质化问题以PD—1/PD—L1药物为例,CDE共受理PD—1注册申请276件,已有42家企业申请申请最多的一家企业申请了59个受理号,一家企业申请了多达33个适应症PD—L1已受理148起案件,29家企业提出申请申请数量最多的是61个,涉及54个适应症两家公司申请的适应症进行了整合,涉及18个肿瘤种类,包括42家企业和155份肺癌验收文件
经过6年的药品审评审批改革,到现在,我们仍然没有摆脱重复申请带来的各种困扰周思源表示,大量临床资源集中在PD—1和PD—L1,这实际上给评审资源,临床研究资源和各方资源带来了困扰也意味着从仿制药的创新审评到创新药的审评,监管部门和行业都面临着挑战
归根结底,这是因为我们早期的R&D是在外国R&D的基础上进行的,而这也是在我们之后。
续要努力的方向周思源说道
摆脱仿制药思路,创新要关注患者需求
医药创新要更关注患者的需求,要对临床价值给予关注,要充分探索临床价值,才能更上一层楼周思源表示
事实上,CDE在7月初发布的《原则》曾引发业界热议该文件强调抗肿瘤药物研发要以临床价值为导向,许多创新药企的股价应声下跌,反映出市场对于新药监管收紧的敏感
对于这一文件的出现背景,周思源认为,是从仿制药的研发到创新药的研发,让药物研发进入新的阶段,但临床前研究对临床价值并没有那么聚焦,还有一些完成作业的心态,此外,临床研究方面也不充分,不能为临床价值的探索和确定提供全面的支持和证据。
我们的临床研究的策略,规划和设计,更多的是考虑临床注册的目的,而不是基于对临床价值的探索周思源说,在药物创新的过程中,药企仍未摆脱仿制药的思路,很多事情是想当然,而临床研究标准偏低的问题,体现在对照组的选择,疗效缺乏依据,样本量估计远远不足等各方面另外,药物临床研发对新理念,新设计,新方法的应用也不足
对于这些转型中的问题,周思源提出了药物创新的三个基本认识其一是药物创新要全面关注各个治疗领域的临床需求,比如罕见病,儿童用药,中药,其二是药物研发是发现,探索,确证临床价值的过程,要以患者为中心,以临床价值为导向,其三是要通过高标准,高质量,高效率的临床研发,为临床价值的评估提供全面,科学的证据
周思源表示,《原则》只是CDE今年想推出的108个指导意见中的一个,后续还会有更多的与药物创新发展规律相适应的要求出台未来,CDE将进一步完善药品审评标准,适应药物创新的需要,发挥好审评标准指挥棒的作用,以临床价值为导向,高标准严要求,推动中国的药物创新真正成为国际认可的全球新,完成从量变到质变的过程
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。